Автор: Вовк Е.И.
Источник: Журнал "Гастроэнтерология" от 23 августа 2013 г. - №20.
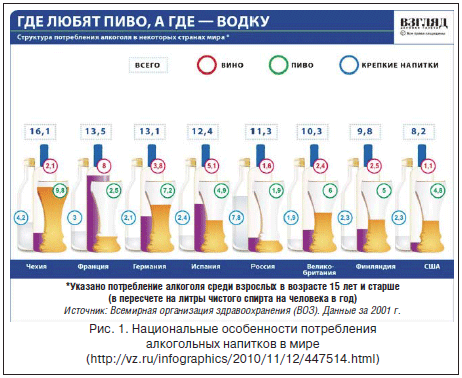
Злоупотребление алкоголем, или хроническая алкогольная интоксикация (ХАИ), является тяжелейшей социальной и медицинской проблемой глобального значения. Во 2-й половине XX в. во всех странах мира произошло значительное увеличение употребления алкогольных напитков, приведшее к росту ассоциированной патологии внутренних органов. Например, в Германии в период с 1978 по 1985 г. распространенность алкогольного цирроза печени (ЦП) увеличилась на 225% [1]. В России к последнему 10-летию XX в. злоупотребление алкоголем приобрело характер национального бедствия. Среди европейских стран Россия стала абсолютным лидером по потреблению алкоголя на душу населения. На долю одного взрослого работающего человека в 1998 г. приходилось около 25 л этанола в год, причем значительную долю составляли крепкие напитки и продукты с высоким содержанием токсичных суррогатов алкоголя [2]. В течение последнего 10-летия удельное потребление алкоголя в России несколько снизилось и составило в 2012 г. менее 14 л на душу населения. Однако в структуре употребляемого алкоголя сохраняется самая большая среди европейских стран доля крепкого алкоголя. В большинстве стран Европы, за исключением Ирландии, Финляндии и Великобритании, с крепкими алкогольными напитками потребляется не более 3,5 л этанола на душу населения в год (рис. 1).
Тем не менее в странах Евросоюза злоупотребление алкоголем является третьей по частоте причиной потери здоровья после сердечно-сосудистых заболеваний и курения, поражение внутренних органов вследствие ХАИ значительно чаще, чем в мире, становится причиной смерти (соответственно 4,6 и 3,8% всех летальных исходов) или инвалидности (соответственно 11,5 и 6,5% DALYs (disability-adjusted life year) [3]. Около 10% DALYs вследствие злоупотребления алкоголем приходится на долю алкогольной болезни печени (АБП) [2]. Однако в ряде стран, например, в Португалии, этот показатель существенно выше и составляет 31,5% алкоголь-ассоциированной недееспособности [4].
Активное внедрение социально-экономических методов борьбы с ХАИ (увеличение стоимости спиртного, промотирование слабого алкоголя, запрет на продажу несовершеннолетним и т.д.), а также пропаганда здорового образа жизни привели в течение последних 30 лет к существенному уменьшению частоты летальной АБП во многих странах Европы, например во Франции и Италии. В период с 1970 по 2004 г. смертность, ассоциированная с АБП, в Европе снизилась на 60% (с 13,8 до 8,01 на 100 тыс. человек в возрасте до 65 лет) [5]. В то же время частота летальной АБП неуклонно растет в Великобритании, Ирландии, Финляндии, Восточной Европе и России. Этому росту, помимо также распространенной в этих странах привычки к крепкому алкоголю, способствуют глобальный экономический кризис последних лет, социальные проблемы и безработица в странах Восточной Европы в течение уже более чем 20 лет. Доказано, что рост безработицы на 3% приводит к 28% приросту смертности от заболеваний, ассоциированных со злоупотреблением алкоголем [6].
Поскольку наиболее высокая летальность характерна для алкогольного ЦП, этот показатель служит своего рода индикатором потребления алкоголя в каждой конкретной стране. Среди европейских стран наиболее высокая смертность от ЦП зафиксирована в 1997-2001 гг. в Великобритании - 14,1 на 100 тыс. взрослого населения [7]. В России уровень смертности от алкогольного ЦП был и остается значительно выше - в 2010 г. в крупных городах она достигла 50 на 100 тыс. населения [8]. Известно, что дорога к ЦП начинается с развития потенциально обратимых стеатоза (80-90% пациентов с ХАИ) и хронического стеатогепатита (30-40% пациентов с ХАИ), на фоне которых постепенно формируются фиброз и ЦП, развиваются хроническая печеночная недостаточность и портальная гипертензия (15-20% пациентов с ХАИ) [9].
При ХАИ прогрессирование АБП от стеатоза к циррозу - процесс, коррелирующий с количеством, стажем и характером употребления алкоголя. Однако согласованных научных данных относительно дозы алкоголя, прямо сопряженной с риском развития ЦП или летальным исходом, до сих пор не получено: опасная доза варьирует от 25 до 100 г чистого этанола в сутки. В среднем прием 60-80 г этанола в сутки для мужчин и более 20 г в день для женщин в течение более 10 лет сопряжен с высоким риском формирования АБП [9]. Относительный риск АБП и смерти от ЦП возрастает с ростом дозы алкоголя: при 50 г/сут увеличивается в 2 раза, а при 100 г/сут - уже в 5 раз как у мужчин, так и у женщин, причем вне зависимости от возраста и наличия или отсутствия коморбидной патологии внутренних органов [10, 11]. С другой стороны, регулярное употребление небольших доз этанола (до 15 г/сут для мужчин и до 10 г/сут для женщин), по данным целого ряда исследователей, защищает от развития ССЗ, особенно в пожилом возрасте [12, 13]. Более того, в ряде исследований показано, что такое «легкое» употребление алкоголя может препятствовать развитию инсулинорезистентности, в т.ч. у пациентов с ожирением [14].
Механизм формирования системных метаболических нарушений и патологии внутренних органов при злоупотреблении алкоголем
Высокая частота АБП при злоупотреблении алкоголем обусловлена тем, что печень является органом, метаболизирующим 75-98% поступившего в организм этанола. В гепатоцитах и клетках других тканей этанол под действием цитозольного фермента алкогольдегидрогеназы (ADH) и микросомального фермента цитохрома P-450 2E1 окисляется до ацетальдегида. Ацетальдегид превращается в ацетат посредством фермента ацетальдегиддегидрогеназы. Обе эти реакции производят восстановленный NADH (NAD+H: C2H5OH+2NAD→ C2H4O+2NAD+H) и уменьшают окислительный потенциал гепатоцита - при ежедневном поступлении больших доз развиваются оксидативный стресс и гипоксия гепатоцита, которые нарушают весь биохимизм клетки. Далее ацетат метаболизируется в цикле карбоновых кислот, в результате чего образуются углекислый газ и энергия: C2H4O→CO2+Н2O+энергия (рис. 2).
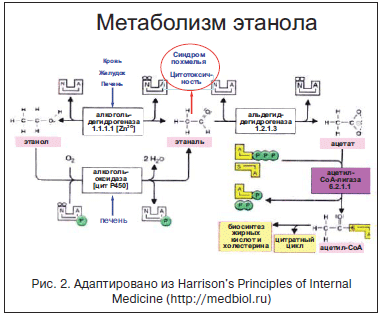
При редком употреблении большого количества этанола за непосредственное повреждение тканей и интоксикацию (похмелье) более всего «ответственны» метаболический ацидоз, электролитные нарушения, а также нейротропные и сосудистые эффекты алкоголя как универсального вазодилататора и седативного агента.
При ХАИ нарушения биохимизма тканей становятся перманентными (табл. 1) - в центре метаболических нарушений оказываются последствия окисления большого количества этанола, ацидоз и накопление ацетальдегида.

Избыток «легких» алкогольных углеводов приводит к увеличению синтеза свободных жирных кислот, а накопление ацетальдегида и оксидативный стресс - к замедлению β-окисления жирных кислот. Оба процесса результируют в накоплении токсичных жирных кислот, которые гепатоцит превращает в триглицериды, а также холестерина - развивается стеатоз. Стеатогепатит и глубокие стереотипные нарушения биохимизма гепатоцитов и клеток других органов-мишеней (кардиомиоцитов, нейронов, клеток поперечно-полосатых мышц) развиваются при «тяжелой» ХАИ. Вследствие нарушения баланса между образованием и деградацией ацетальдегида и его накопления в цитозоле происходит разрушение полиненасыщенных жирных кислот, входящих в состав фосфолипидов клеточных мембран. Вследствие этого нарушается деятельность связанных с ними транспортных Na+- и Ca++-зависимых ферментных систем, меняются структура и антигенные свойства мембранных рецепторов.
Постоянная потребность в окислении большого количества этанола приводит к индукции P-450 2E1 и стимуляции окислительного стресса с образованием большого количества реактивных форм кислорода. В условиях дефицита внутриклеточных антиоксидантных систем (глутатион-пероксидаза, супероксиддисмутаза и каталазы) кислородные радикалы активируют ПОЛ, снижают активность протеосом, что нарушает катаболизм поврежденных белков и способствует накоплению цитокератина - образованию телец Мэллори. Токсические продукты ПОЛ (малондиальдегид) еще больше увеличивают дефицит глутатиона - образуются аномальные митохондрии. В клетке накапливается гомоцистеин, еще более потенцирующий деградацию эндоплазматического ретикулума. Под влиянием ПОЛ происходит активация комплемента и TNF-рецептора 1 (TNF-R1), который активирует каспазы, запускающие апоптоз гепатоцитов. Реактивные формы кислорода и продукты ПОЛ участвуют в образовании белковых карбонилов и реагируют с ДНК и структурными белками, превращая их в антигены, активирующие иммунное воспаление (рис. 3).
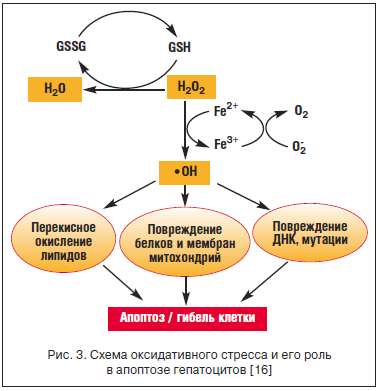
Изначально воспаление в паренхиме печени является асептическим. В ответ на повреждение гепатоцитов и образование в них антигенов иннантная иммунная система запускает воспаление, а затем и фиброгенез посредством гуморальных факторов (комплемент, интерфероны) и активности различных фагоцитирующих лейкоцитов - нейтрофилов, моноцитов, лимфоцитов и специализированных макрофагов, обеспечивающих секрецию медиаторов воспаления (клетки Купфера). Исследования последних лет убедительно показали, что иммунный ответ в паренхиме печени также мощно стимулируют липополисахариды бактериального происхождения, поступающие в печень из кишечника. Через стимуляцию паттерн-распознающих рецепторов (PRRs) и толл-подобных рецепторов (TLR) на поверхности клеток Купфера липополисахариды активируют секрецию провоспалительных медиаторов: цитокинов (наиболее активны TNFα и IL-1) и хемокинов (IL-8, MCP-1. СXС) [17]. Активация клеток Купфера происходит и под прямым воздействием системы комплемента (преимущественно его С3 и С5 компонентов) [18]. Сенсибилизированные клетки Купфера регулируют еще одно иммунное звено, участвующее в поддержании как воспаления, так и регенерации клеток печени - секретируемые ими IL-1 и IL-6 регулируют дифференцировку CD4+/CD8 Т-лимфоцитов-хелперов (клеточный иммунитет слизистой оболочки кишечника). Эти лимфоциты в свою очередь секретируют IL-17 и IL-22. IL-17 активирует стеллатные клетки, вырабатывающие хемоаттрактанты для нейтрофилов, активно мигрирующих в паренхиму печени при стеатогепатите - количество нейтрофилов в портальных трактах служит гистологическим маркером активности алкогольного гепатита. Бактериальные липополисахариды также могут стимулировать фиброгенез посредством стимуляции секреции тромбоцитарного фактора роста (PDGF) и трансформирующего фактора роста бета (TGF-β) стеллатными клетками.
Кроме провоспалительных сенсибилизированные клетки Купфера секретируют и защитные противовоспалительные и антифибротические цитокины IL-6, IL-10, IL-22, контактирующие с системой STAT-белков, которая стимулирует репарацию ДНК и пролиферацию гепатоцитов [19, 20].
Наиболее характерные гистологические признаки алкогольного гепатита - наличие телец Мэллори на фоне баллонной дистрофии, стеатоз и некрозы гепатоцитов, расположенных главным образом в центре печеночной дольки (зона III). Характерны инфильтрация печеночной дольки макрофагами и сегментоядерными лейкоцитами, отек зоны III, стеатоз и отложение коллагена с преимущественно перисинусоидальным расположением волокон. Во всех случаях, даже на фоне выраженного фиброза, при ХАИ в гистологических препаратах имеются признаки стеатоза и внутрипеченочного холестаза различной степени выраженности (рис. 4-7) [21].
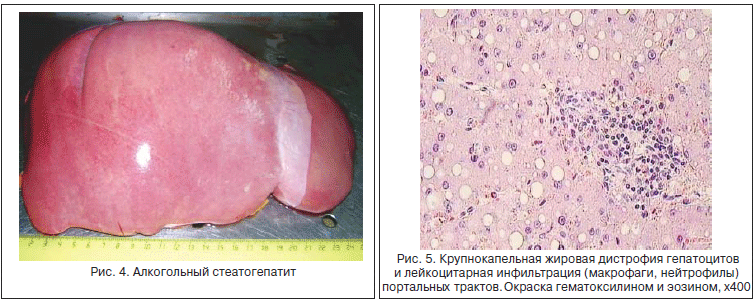
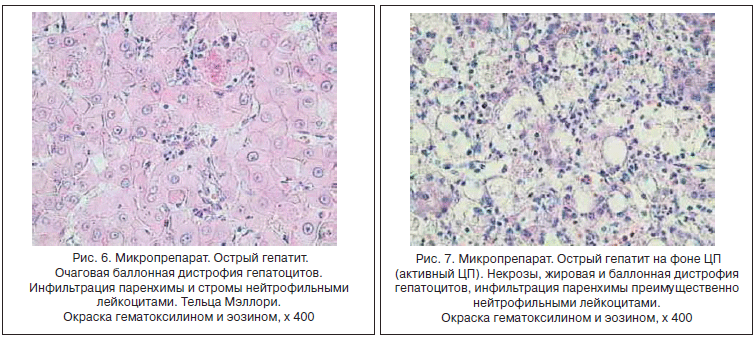
Наиболее тяжелые нарушения биохимизма и структуры паренхимы печени развиваются при «тяжелой» ХАИ. К ней прежде всего относят один из наиболее токсичных для печени сценариев злоупотребления спиртным - частые пьянки (binge-drinking, too much too fast), во время которых в течение двух первых часов принимается >70 мл этанола для мужчин и >55 мл для женщин - доза, создающая токсичную концентрацию этанола в крови (≥0,08) [22]. Особенно опасным этот режим алкоголизации становится при приеме спиртного натощак, поскольку приводит к травматичным для клеток печени, центральной нервной системы (ЦНС) и миокарда нарушениям метаболизма: гипогликемии, гликогенолизу, метаболическому ацидозу и гиперметаболическому состоянию - основным триггерам оксидативного стресса и воспаления. Частые эпизоды гипогликемии вinge-drinking особенно тесно связаны с риском развития инсулинорезистентности и метаболического синдрома [9].
Второй стереотип «тяжелой» ХАИ и самая частая причина активного алкогольного гепатита - регулярное тяжелое опьянение (drinking too much too often), или употребление >70-80 г этанола в сутки более 3 р./нед. [23]. У пациентов, отказавшихся от приема алкоголя, прогрессирование АБП обусловлено прогрессированием хронического гепатита вследствие нарушения биоценоза кишечника, интеркурентных инфекций, а также влияния коморбидных факторов (ожирения, хронической сердечной недостаточности, легочного сердца, лекарственной и другой токсической нагрузки). У продолжающих принимать алкоголь основной причиной декомпенсации АБП и летального исхода является обострение хронического гепатита с декомпенсацией печеночно-клеточной функции (acute-on-chronic liver failure). Другой причиной летальных исходов при ЦП является портальная гипертензия, которая приводит к массивным кровотечениям из варикозных вен.
Коморбидность у пациентов с АБП
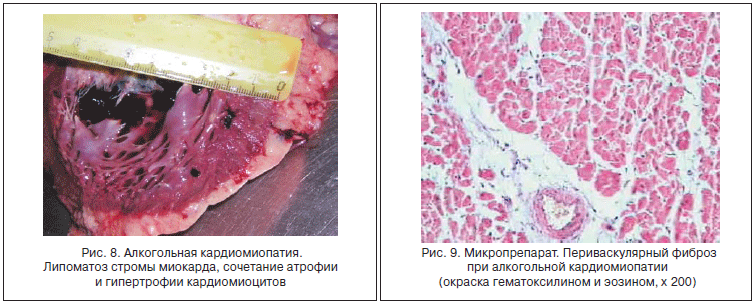
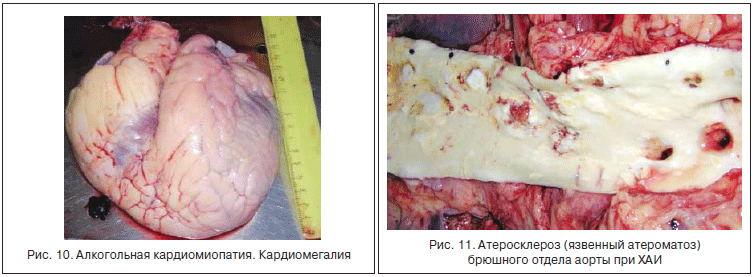
ХАИ является системным заболеванием, формирующим на базе универсальных дозозависимых метаболических и иммунно-воспалительных нарушений стереотипную патологию органов-мишеней. Однако поражение органов-мишеней, коррелирующее с тяжестью АБП, имеет и некоторую органную специфичность. Так, для функционирования «возбудимых» клеток ЦНС, скелетной мускулатуры и кардиомиоцитов уже на ранних стадиях ХАИ большое значение имеют нарушение проведения импульсов через поврежденную наружную клеточную мембрану и в цитозоле (деградация фосфолипидов, нарушение работы ионных каналов, изменение количества и структуры рецепторов), а также дисфункция мембран митохондрий, саркоплазматического ретикулума и саркомеров. Клинически значимая алкогольная миопатия с диффузным поражением скелетной мускулатуры развивается более чем у 50% пациентов с ЦП [24]. Формирование миопатии, как и алкогольной кардиопатии, начинается в самом начале ХАИ и в течение долгого времени остается полностью обратимым в случае отказа от приема алкоголя. Развитие стойкой мышечной слабости и необратимой атрофии происходит приблизительно на уровне суммарного употребления 20 г этанола на 1 кг веса тела. Алкогольная кардиопатия, как и АБП, также является «дозозависимой» патологией, несмотря на то, что суммарный риск поражения сердца при ХАИ выше у женщин и людей с генетическими дефектами в активности ацетальдегиддегидрогеназы. У 30% пациентов с ХАИ диастолическая дисфункция сердца формируется при уровне этанола 5 г/кг веса, а систолическая дисфункция - у 13% больных, принявших этанола >9 г/кг веса. По данным аутопсий, алкогольная кардиопатия развивается у всех умерших от ХАИ и имеет стереотипные патолого-анатомические признаки: кардиомегалия, отложение жира под эпикардом, дряблость и «глинистый» вид миокарда, утолщение стенки левого желудочка, расширение полостей сердца, утолщение эндокарда, атеросклероз коронарных артерий и ветвей аорты [25].
При микроскопии типично выявляются периваскулярный фиброз, диффузный мелкоочаговый кардиосклероз, липофиброз миокарда, чередование гипертрофии и атрофии кардиомиоцитов с их жировой дистрофией и отложение в них липофусцина (рис. 8-11) [21].
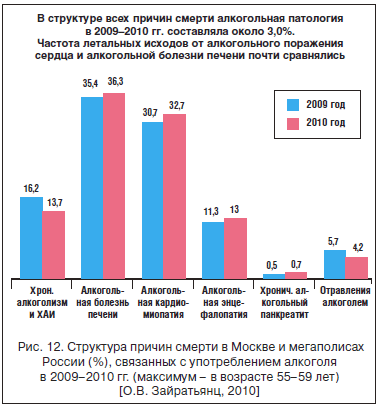
Клинически диастолическая дисфункция сердца приводит к артериальной гипертонии, а систолическая - к развитию дилатационной кардиопатии и систолической сердечной недостаточности, частота которой в России неуклонно растет [8]. Оба варианта кардиопатии становятся причиной различных нарушений ритма сердца и внезапной смерти (рис. 12). Все гистологические проявления и симптомы алкогольной кардиопатии потенцируют хроническое употребление кокаина и злостное курение.
ХАИ дозозависимо вызывает поражения ЦНС: у принимающих более 60 г этанола в сутки в 2,18 раза увеличивает риск геморрагического инфаркта головного мозга. Алкогольная деменция развивается у 70% пациентов, а дегенерация мозжечка - у 30% с ХАИ при суммарной дозе алкоголя >4 г/кг веса [26]. Клинически значимая периферическая и автономная нейропатия развивается у 20% женщин, употребляющих >40 г/сут, и у мужчин - более 60 г/сут [27]. К другим специфическим поражениям ЦНС, тесно связанным с нарушением питания, электролитного и витаминного статуса, относят энцефалопатию Корсакова-Вернике (витамин В1), центральный миелинолиз моста и пеллагру (никотинамид). По данным аутопсий, для поражений головного мозга при ХАИ характерны: фиброз мягкой мозговой оболочки, мелкоточечные кровоизлияния в подкорке, хвостатом и чечевицеобразном ядрах, гипоталамусе, кальцинаты в сосудистых сплетениях желудочков мозга. Извилины головного мозга сглажены, борозды расширены, преимущественно в лобных и височных долях. Стенки артерий мозга склерозированы, имеются очаги фибриноидного некроза [25]. Характерно, что в головном мозге наиболее выражены последствия индуцированного ХАИ апоптоза и нарушения клеточной регенерации - в коре лобной и височной областей, в мозжечке и гипоталамусе отмечаются обеднение клеточных элементов, значительное увеличение по сравнению с нормой числа распадающихся нейронов (рис. 13) [21].
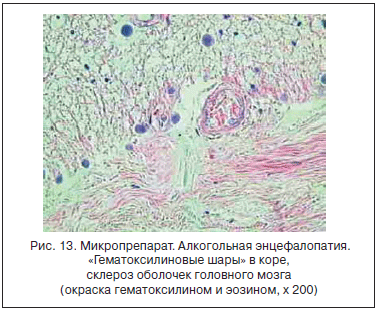
Для «спокойных» клеток желез, кишечника и других, так же как и для печени, более важны метаболические, гормональные, иммунологические и воспалительные повреждения, ассоциированные с ХАИ. Учитывая важнейшую роль транслокации бактериальных липополисахаридов из кишечника в печень для развития и прогрессирования АБП, у пациентов с ХАИ необходимо активно выявлять и лечить патологию ЖКТ. Ассоциированное с ХАИ поражение ЖКТ формируется под прямым токсическим воздействием этанола и ацетальдегида, а также вследствие системной интоксикации, электролитного дисбаланса, активизации местной нейроэндокринной и иммунной систем. Совокупное влияние этих факторов снижает плотность межклеточных контактов, увеличивает секрецию антител и цитокинов на поверхности эпителия - приводит к высокой ранимости слизистой оболочки, увеличивает количество микрофлоры и нарушает микробный пейзаж [28]. Доказано, что у пациентов с ХАИ всегда развивается избыточный бактериальный рост с увеличением пропорции условно патогенной грамотрицательной палочковой и вытеснением индигенной бактериальной флоры (рис. 14).
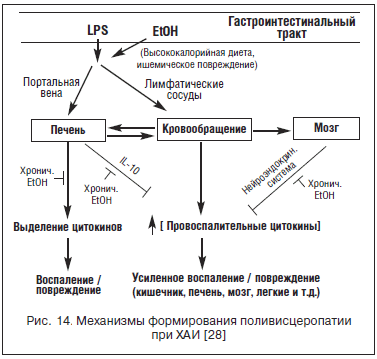
Для алкоголь-ассоциированного поражения кишечника характерно снижение общей (иммунологической, токсической и механической) толерантности слизистой оболочки. Как уже говорилось, это приводит к транслокации бактериальных липополисахаридов в печень, что играет активирующую роль в развитии воспаления в паренхиме печени, фиброгенезе, а также в формировании системного гуморального и клеточного воспалительного ответа. При этом повреждение тканей происходит не только локально, как в печени, а также вследствие системных нарушений иммунитета и посредством сенсибилизированных в кишечнике CD4+/CD8+ лимфоцитов. Ассоциированные с ХАИ нарушения иммунитета снижают резистентность организма к инфекциям, что играет ключевую роль в развитии заболеваний органов дыхания. По данным патолого-анатомических исследований, у всех умерших с ХАИ имеет место хронический бронхит c выраженным периваскулярным и перибронхиальным фиброзом (рис. 15, 16).
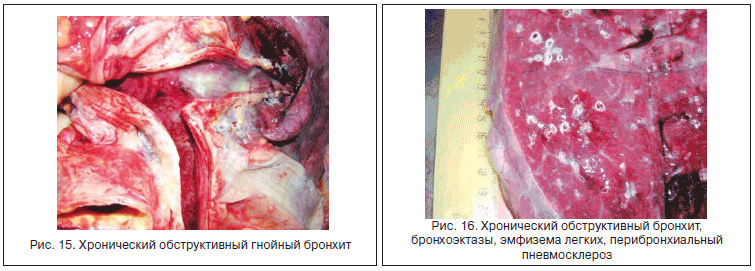
При микроскопическом исследовании обращала на себя внимание более высокая, чем в норме, частота множественных двухсторонних микроателектазов легких, которые являются одной из важнейших причин высокой частоты развития тяжелой долевой или очагово-сливной мультифокальной пневмонии у больных с ХАИ [21, 25].
У всех умерших от ХАИ имели место выраженные изменения в поджелудочной железе - уплотнение и фиброз стромы с нарушением ее дольчатой структуры и наличием петрификатов в 90% случаев. При микроскопии во всех случаях присутствовал мелкоочаговый перидуктальный склероз с крупными полями склероза паренхимы и атрофией ацинарных клеток. В 69% случаев дольковые протоки были расширены, в них находились белковые преципитаты, в 28% случаев в паренхиме отмечалась лимфо-гистиоцитарная инфильтрация [25]. Таким образом, у больных с ХАИ, даже на стадии компенсированной алкогольной поливисцеропатии, имело место отчетливое стереотипное поражение практически всех внутренних органов. Его отличительными особенностями являются жировая дистрофия внутренних органов, прежде всего печени и сердца; фиброз и склероз в строме сердца, печени, легких и поджелудочной железы, гибель нейронов в головном мозге, гиалиноз и выраженный склероз артерий, а также системная микроангиопатия с повышением проницаемости сосудов микроциркуляторного русла, отражающая как интоксикацию, так и высокий уровень системного воспаления.
Факторы риска и прогрессирования АБП
Употребление рискованных количеств алкоголя, по данным эпидемиологических исследований, приводит к развитию АБП только у 6-41% пациентов и преимущественно - у часто выпивающих [9]. При одинаковом сценарии ХАИ развиваются различные по тяжести и потенциалу прогрессирования формы АБП. Эта индивидуальная вариабельность определяется совокупностью генетических факторов, влиянием окружающей среды и коморбидного статуса пациента (табл. 2).
Женщины в 2 раза более предрасположены к АБП: склонны к развитию более тяжелых поражений под воздействием низких доз алкоголя и меньшей продолжительности ХАИ. Это объясняется более медленным эстрогензависимым печеночным и внепеченочным метаболизмом алкоголя, более высоким содержанием жировой ткани, меньшей устойчивостью к оксидативному стрессу и определенным активирующим влиянием эстрогенов на различные звенья иннантного иммунитета и воспалительного каскада в паренхиме печени [29].
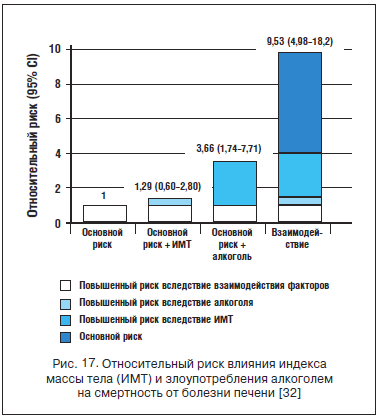
Течение АБП существенно отягощает ожирение (особенно висцеральное), которое также является причиной неалкогольной жировой болезни печени (НАЖБП). Общие при АБП и НАЖБП патогенетические механизмы (индукция СУР 450 2Е1, оксидативный стресс и ПОЛ, активная выработка провоспалительных цитокинов и факторов фиброгенеза жировой тканью) повышают активность гепатита, способствует раннему формированию ЦП и увеличивают смертность от всех форм АБП. По данным C. Hart et al. (2010), сочетание ожирения и злоупотребления алкоголем экспоненциально увеличивает риск смерти от заболевания печени по сравнению с непьющими или людьми с нормальным весом. У употребляющих более 15 доз этанола в неделю с нормальным весом риск смерти от любой формы патологии печени выше в 3,16 раза (95% confidence interval 1,28 to 7,8), у пьющих и страдающих избыточным весом - в 7,01 (3,02 to 16,3), у пьющих пациентов с ожирением - в 18,9 (6,84 to 52,4) раза [30]. У страдающих ожирением и малопьющих (1-14 доз алкоголя в неделю) относительный риск смерти оказался немногим меньше - 5,3 (1,36 to 20,7) (рис. 17).
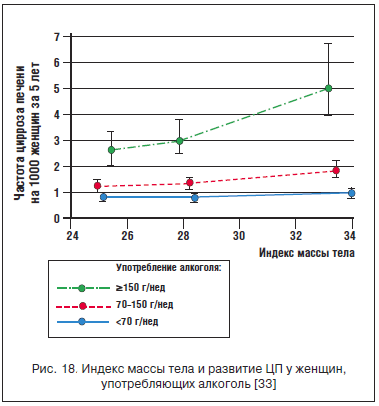
Ожирение активно потенцирует воспалительный каскад и особенно фатально увеличивает риск ЦП у женщин, употребляющих более 150 г этанола в неделю (рис. 18).
По данным B. Liu et al., ожирение на 17% увеличивает частоту встречаемости неалкогольного и на 42% - частоту алкогольного ЦП [31, 37]. Характерно, что в общей медицинской практике метаболическое ожирение и избыточный вес нередко препятствуют своевременной диагностике алкогольного ЦП, который эмпирически ассоциируют с дефицитом массы тела. На самом деле жировая инфильтрация печени и других внутренних органов-мишеней: сердца, головного мозга и скелетной мускулатуры при злоупотреблении алкоголем является высокоспецифичным и, в начале, обратимым маркером регулярного употребления больших доз алкоголя.
Вопреки обыденному восприятию избыточной массы тела висцеральное ожирение у пациентов с АБП совершенно не свидетельствует о полноценном и калорийном питании. Напротив, по мере углубления нарушений печеночно-клеточной функции у пациентов нарастают глубокие нарушения нутриентного статуса, прежде всего в отношении незаменимого белка (метионин, цистеин) и микронутриентов (марганец, литий, селен, цинк), эссенциальных фосфолипидов (ЭФЛ) (полиненасыщенные жирные кислоты) и витаминов (тиамин, фолиевая кислота, каротины, токоферол, рибофлавин, никотинамид, витамин К) [28, 32, 33]. Расстройства ассимиляции, характерные для печеночной недостаточности, усугубляет присоединение мальабсорбции вследствие недостаточности внешней и эндокринной секреции поджелудочной железы, билиарной недостаточности и избыточного бактериального роста в ЖКТ. Мальабсорция преимущественно ухудшает усвоение жиров и проявляет дефицит жирорастворимых витаминов и эссенциальных липидов, а также форсирует остеопороз [34]. Нарушение питательного статуса, как и ожирение, значительно снижает толерантность к токсическому действию алкоголя и потенцирует патологические метаболические иммунно-воспалительные процессы, вызываемые ХАИ, - поэтому требует активного выявления и коррекции.
Диагностика и лечение алкогольной поливисцеропатии
Своевременное лечение алкогольной поливисцеропатии значительно затруднено прежде всего потому, что у 90% пациентов с ранними формами алкогольной поливисцеропатии в течение долгих лет не возникает нозологически очерченных поражений внутренних органов, которые могут быть соотнесены со злоупотреблением алкоголем. В терапевтической клинике у таких пациентов обычно диагностируют обострение сердечно-сосудистых заболеваний, чаще - артериальную гипертонию или хроническую обструктивную болезнь легких, реже - хронический панкреатит или обострение язвенной болезни. Основными причинами госпитализаций больных являются острый панкреатит, осложненная язвенная болезнь, «алкогольная травма» и пневмония [21]. В России, как и в других больших странах с близкой социальной структурой и уровнем жизни городского населения, например в Бразилии, больные с обострением алкогольной поливисцеропатии составляют до 80% срочных госпитализаций нехирургических больных в отделение интенсивной терапии многопрофильного стационара [35]. В клинической практике у таких пациентов, как правило, эмпирически диагностируют ХАИ, однако пристальное внимание к их алкогольному анамнезу возникает почти исключительно при необходимости экстренных оперативных вмешательств - для прогнозирования синдрома отмены в раннем послеоперационном периоде. На самом деле у этих пациентов «доклинический» этап необходимо рассматривать как первую стадию алкогольной поливисцеропатии, поскольку специфические мультиорганные поражения внутренних органов не только уже существуют, но и нередко становятся причиной летального исхода.
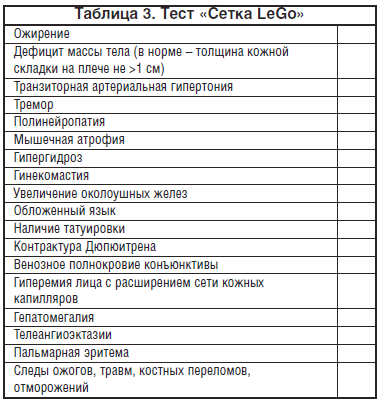
Для выявления факта и характера ХАИ принято использовать стандартизованные тесты CAGE, AUDIT, а для выявления, в частности, ее соматических эквивалентов - опросник «Сетка LeGo» (P.M. LeGo, 1976), стандартизованный и модифицированный для применения в России [36]. Сочетание 7 и более признаков свидетельствует о наличии хронической алкогольной поливисцеропатии (табл. 3).
Применение теста в исследовании, предпринятом в 2005-2006 гг. в одном из многопрофильных стационаров г. Москвы, позволило диагностировать алкогольную поливисцеропатию у 44% больных различного пола и возраста, госпитализированных в кардиологические и терапевтические отделения стационара [21].
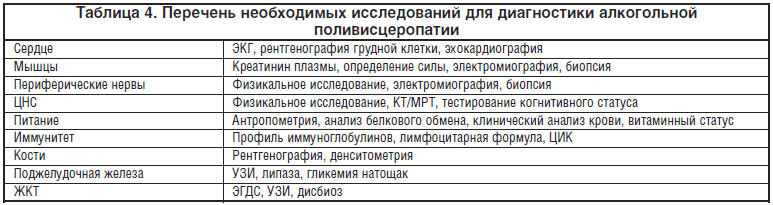
Для выявления алкогольной поливисцеропатии целесообразно выполнить минимальный объем исследований, который позволит установить тяжесть и показания для лечения (табл. 4) [28].
Международные и российские клинические рекомендации по лечению АБП строго регламентируют алгоритмы действий и объем лекарственной терапии при потенциально летальных формах АБП: синдроме отмены, тяжелом остром алкогольном гепатите и декомпенсированном ЦП [38-41]. Среди фармакологических воздействий в фокусе этих клинических рекомендаций находят применение:
- бензодиазепины для лечения синдрома отмены;
- терлипрессин для лечения и профилактики гепаторенального синдрома и кровотечений из варикозно расширенных вен пищевода;
- преднизолон при лечении гистологически верифицированного тяжелого острого гепатита;
- N-ацетилцистеин как антиоксидант;
- отказ от эмпирического назначения антибиотиков;
- парентеральное питание.
В то же время за рамками клинических рекомендаций остаются практически все аспекты длительного противовоспалительного и антифибротического лечения метаболических нарушений и специфической, но коморбидной для АБП патологии внутренних органов. Активное воздействие на эти патогенетические механизмы, без сомнения, могло бы значительно улучшить прогноз: замедлить прогрессирование АБП и полиорганной недостаточности, снизить летальность и улучшить качество жизни больных. Одной из попыток применения новых молекулярных технологий противовоспалительного воздействия было применение, правда, в эксперименте IL-6 и IL-22 при остром алкогольном гепатите. С целью антифибротического воздействия была предпринята попытка применения пентоксифиллина как антагониста TNFα - медиатора, ассоциированного с ХАИ повреждения и фиброза печени. Терапия пентоксифиллином оказалась успешной в отношении маркеров воспаления и фиброза, однако привела к увеличению смертности пациентов с тяжелым алкогольным гепатитом вследствие повышения частоты инфекционных осложнений [42].
В целом лечение стабильных форм АБП при относительно сохранной печеночно-клеточной функции на практике отнесено к сфере симптоматической терапии, должно проводиться в амбулаторной практике и поэтому находится в сфере деятельности не столько гастроэнтеролога, сколько врача общей практики, семейного врача или участкового терапевта. Приоритетами в этом направлении необходимо признать лечение ожирения и инсулинорезистентности, коррекцию других метаболических нарушений (гипопротеинемия, дислипидемия, остеопороз, дефицит макро- и микронутриентов), избыточный бактериальный рост в кишечнике, аспекты неблагоприятного лекарственного взаимодействия при полифармакотерапии и все ресурсы противовоспалительного лечения, включая гепатопротекторы.
В этом классе препаратов в качестве противовоспалительных и антифибротических средств перспективно применение ЭФЛ (с учетом большого клинического опыта и одобрения экспертов). В последние годы в ряде контролируемых клинических исследований было показано, что лечение ЭФЛ при АБП приводит к улучшению лабораторного профиля и увеличивает толерантность к ХАИ, оказывает прямое антифибротическое действие [43]. В эксперименте было показано, что это противовоспалительное и антифибротическое действие реализуется через дозозависимое уменьшение ПОЛ, вызванного оксидативным стрессом, а также уменьшением TGF-α зависимой активации стеллатных клеток [44, 45]. По данным метаанализа, эффективность ЭФЛ при АБП составляет 83,5% [46].
ЭФЛ особенно эффективны в отношении жировой болезни как алкогольной, так и неалкогольной природы, поскольку посредством содержащихся в них полиненасыщенных жирных кислот на молекулярном уровне прямо активируют окисление свободных жирных кислот в пероксисомах клеток [15]. Помимо гепатопротекторной активности, терапия ЭФЛ значительно улучшает липидный профиль (снижает титры ЛПНП и триглицеридов), а также нормализует структуру и функциональное состояние других тканей с высоким содержанием фосфолипидов: головного мозг, клеток крови, слизистой оболочки желудка [47-49].
Некоторые препараты ЭФЛ имеют преимущества при лечении алкогольного стеатогепатита и ЦП, поскольку вносят свой вклад в коррекцию характерного для АБП дефицита незаменимых аминокислот и белка. Метионин и ЭФЛ усиливают действие друг друга, улучшают функциональное состояние клеток печени и оказывают гепатопротекторный эффект.
Таким образом, пока детальная расшифровка молекулярных механизмов АБП еще не привела к созданию новых эффективных методов лечения, в арсенале опытного врача уже имеются надежные препараты для плановой длительной терапии алкогольной поливисцеропатии.
Литература
1. Майер К.П. Гепатит и последствия гепатита / пер. с нем. - М.: Медицина, 1999. - С.315-316.
2. Нужный В.П., Савчук С.А. Алкогольная смертность и токсичность алкогольных напитков // Партнеры и конкуренты. Лабротариум. - 2005. - №5. - С.15.
3. WHO. European status report on alcohol and health. - 2010. - Copenhagen, 2010.
4. Rehm J., Mathers C., Popova S. et al. Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders // Lancet. - 2009. - Vol.373. - Р.2223-2233.
5. Anderson P., Baumberg B. Alcohol in Europe: a public health perspective. - EU health and consumer protection Directorate General; 2007.
6. Stucker D., Basu S., Suhrcke M. et al. The public health effect of economic crises and alternative policy responces in Europe: an empirical analysis // Lancet. - 2009. - Vol.374. - Р.315-323.
7. Mathurin P., Deltentre P. Effect of binge drinking on the liver: an alarming public health issue? // Gut. - 2009. - Vol.58. - Р.613-617.
8. Отчет Московского городского центра патолого-анатомических исследований Департамента здравоохранения г. Москвы, 2010.
9. Bellentani S., Saccoccio G., Costa G. et al. Drinking habits as cofactors of risk for alcohol induced liver damage // Gut. - 1997. - Vol.41. - Р.845-850. doi:10.1136/gut.41.6.845.
10. Corrao G., Bagnardi V., Zambon A., La Vecchia C. A metaanalysis of alcohol consumption and the risk of 15 diseases // Prev. Med. - 2004. - Vol.38. - Р.613-619.
11. Yang L., Zhou M., Sherliker P. et al. Alcohol drinking and overall and cause-specific mortality in China: nationally representative prospective study of 220 000 men with 15 years of follow-up // Int. J. Epidemiol. - 2012. - Vol.41 (4). - Р.1101-1113.
12. Snow W.M., Murray R., Ekuma O. Alcohol use and cardiovascular health outcomes: a comparison across age and gender in the Winnipeg Health and Drinking Survey Cohort // Age Ageing. - 2009 Mar. - Vol.38(2). - Р.206-212.
13. Paganini-Hill A., Kawas C.H., Corrada M.M. Type of alcohol consumed, changes in intake over time and mortality: the Leisure World Cohort Study // Age Ageing. - 2007. - Vol.36(2). - Р.203-209.
14. Fueki Y., Miida T., Wardaningsih E. et al. Regular alcohol consumption improves insulin resistance in healthy Japanese men independent of obesity // Clin Chim Acta. - 2007. - Vol.382(1-2). - Р.71-76.
15. Kuntz E., Kuntz H.-D. Гепатология. Учебное пособие и атлас. 3-е изд. - Springer Press, Heidelberg, 2008. - Гл.29. - С.396.
16. Rubin’s pathology: clinicopathologic foundations of medicine. - E. Rubin ed., 4th ed., Lippincott Williams & Wilkins, 2004. - Р.82.
17. Gao B., Seki E., Brenner D.A. et al. Innate immunity in alcoholic liver disease // Am. J. Physiol. Gastroenterol. Liver Physiol. - 2011. - Vol.300. - Р.516-525.
18. Voican C.S., Perlemuter G., Naveau S., Mechanisms of the inflammatory reaction implicated in acute alcoholic hepatitis: 2011 update // Clin. Res. Hepatol. Gastroenterol. - 2011. - Vol.35. - Р.465-474.
19. Gao B. Cytokines, STATs and liver disease // Cell Mol Immunol. 2005. - Vol.2 (2). - Р.92-100.
20. Zhang X., Tachibana S., Wang H. et al. Interleukin-6is an important mediator for mitochondrial DNA repair after alcoholic liver injury in mice // Hepatology. - 2010, Dec. - Vol.52(6). - Р.2137-2147.
21. Верткин А.Л., Зайратьянц О.В., Вовк Е.И. Окончательный диагноз. - М.: ГЭОТАР-Медиа, 2008.
22. Alcohol & Public Health: Fact Sheets - Binge Drinking. Centers for Disease Control and Prevention. - 7 November 2012.
23. Hatton J., Burton A., Nash H. et al. Drinking patterns, dependency and life-time drinking history in alcoholrelated liver disease // Addiction. - 2009. - Vol.104(4). - Р.587-592.
24. Urbano-Marquez A., Fernandez-Soya J. The effects of alcohol on sceletal and cardiac muscle // Muscle Nerve. - 2004. - Vol.30. - Р.689-707.
25. Пауков С.В., Ерохин Ю.А. Патологическая анатомия пьянства и алкоголизма // Архив патологии. - 2004. - №4. - С.3-9.
26. Harper C., Matsumoto I. Ethanol and brain damage // Curr. Opin. Pharmacol. - 2005. - Vol.5. - Р.73-78.
27. Chopra K., Tiwari V. Alcoholic neuropathy: possible mechanisms and future treatment possibilities // Br. J. Clin. Pharmacol. - 2011. - Vol.10. - Р.1365.
28. Wang H. J., Zakhari S., Katherine M. J. Alcohol, inflammation, and gut-liver-brain interactions in tissue damage and disease development // World J Gastroenterol. - 2010. - Vol.16 (11). - Р.1304-1313.
29. Sato N., Lindros K.O., Baraona E. et al. Sex difference in alcohol-related organ injury // Alcohol Clin. Exp. Res. - 2001. - Vol.25. - Р.40-45.
30. Hart C., Morrison D., Batty G. et al. Effect of body mass index and alcohol consumption on liver disease: analysis of data from two prospective cohort studies // BMJ. - 2010. - Vol.340. - Р.1240.
31. Liu B. et al. Body mass index and risk of liver cirrhosis in middle aged UK women: prospective study // BMJ. - 2010. - Vol.340. - Р.912.
32. Sanvisebs A., Rivas I., Bolao F. et al. // Med. Clin. (Barc.) - 2011. - Vol.137. - Р.49-59.
33. Estruch R., Sacanella E., Fernandes-Soya J., Nicolas J.M. Nutritional status in alcoholics. In: Preedy V.R. ed. The handbook of alcohol related pathology // Elseiver Science Pub., London. - 2005. - Vol.29.Р. 363-377.
34. Peris P., Pares A., Guanabens N. et al. Reduced spinal and femoral bone mass and deranged bone mineral metabolism in chronic alcoholics // Alcohol. - 1992. - Vol.27 (6). - Р.619-625.
35. Ferri-de-Barros J.E., Winter D.H., Cesar K.G. et al. Alcohol drinking-related disorders in 1901 patients treated at Taubate's Municipal Emergency room in 2000: a contribution to sociocentric education in neurology // Arq Neuropsiquiatr. - 2004. - Vol.62 (2A). - Р.307-312.
36. Моисеев B.C. (ред.) Алкогольная болезнь. Поражение внутренних органов при алкогольной болезни. - М., 1990. 129 с.
37. Federico F., D’Aiuto E., Borriello F. et al. Fat: A matter of disturbance for the immune system // World J Gastroenterol. - 2010 October 14. - Vol.16 (38). - Р.4762-4772.
38. National Clinical Guideline Centre for Acute and Chronic Conditions. Alcohol-use disorders. Diagnosis and clinical management of alcohol-related physical complications. London (UK): National Institute for Health and Clinical Excellence (NICE); 2010 Jun. - 30 p. http://www.guideline.gov.
39. O'Shea R.S., Dasarathy S., McCullough A.J., Practice Guideline Committee of the American Association for the Study of Liver. Alcoholic liver disease // Hepatology. - 2010 Jan. - Vol.51(1). - Р.307-328.
40. Mathurin P., Hadengue A., Bataller R. et al. EASL Clinical Practical Guidelines: Management of Alcoholic Liver Disease // J Hepatol. - 2012. - Vol.57. - Р.399-420.
41. Маевская М.В., Морозова М.А., Ивашкин В.Т. Алгоритм ведения пациентов с алкогольной болезнью печени // Рос. журн. гастроэнтерол., гепатол., колопроктол. - 2007. - №17(6). - С.1-10.
42. Gao B., Bataller R. Alcoholic liver disease: pathogenesis and new therapeutic targets // Gastroenterology. - 2011. - Vol.141. - Р.1572-1585.
43. Gundermann K.J., Kuenker A., Kuntz E., Droździk M. Activity of essential phospholipids (EPL) from soybean in liver diseases // Pharmacol Rep. - 2011. - Vol.63(3). - Р.643-659.
44. Ikeda R et al. // Inflamm. Res. - 2011. - Vol.60. - Р.597-604.
45. Okiyama W. et al. // J.Hepatol. - 2009. - Vol.50. - Р.1236-1246.
46. Hu G., Liu K., Zhao L. Polyunsaturated phosphatidylcholine (Essentiale) in the treatment of alcoholic liver disease and fatty liver disease, a systematic review // Liver. - 2005. - Vol.10. - Р.5-7.
47. Miyamoto A., Wakabayashi H., Watanabe A. Abnormality in fatty acid composition of gastric mucosal phospholipids in patients with liver cirrhosis and its correction with a polyunsaturated fatty acid-enriched soft oil capsule // J Gastroenterol Hepatol. - 1997 Oct. - Vol.12 (9-10). - Р.644-652.
48. Kidd P.M. A review of nutrients and botanicals in the integrative management of cognitive dysfunction // Altern Med Rev. - 1999 Jun. - Vol.4(3). - Р.144-161.
49. Jayaraman T., Kannappan S., Ravichandran M.K., Anuradha C.V. Impact of Essentiale L on ethanol-induced changes in rat brain and erythrocytes // Singapore Med J. - 2008 Apr. - Vol.49(4). - Р.320-327.
Публикации по теме:
· Алкоголь
· Алкоголизм
· Влияние алкоголя на организм человека
· Стадии развития алкоголизма
· Доналд Гудвин. Алкоголизм
· Мельников А.В. Алкоголизм
· Морозов Г.В., Рожнов В.Е., Бабаян Э.А. Алкоголизм: Руководство для врачей
· Портнов А.А., Пятницкая И.Н. Клиника алкоголизма
|